Un elemento químico es un tipo de materia compuesta por átomos del mismo tipo; en su forma más simple, tiene un cierto número de protones en su núcleo, lo que hace que pertenezca a una sola categoría clasificada con el número atómico, aunque puede presentar diferentes masas atómicas.
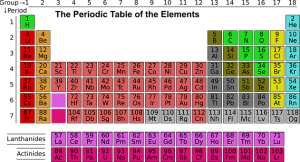
Es un átomo con características físicas únicas, la sustancia que no puede ser descompuesta por reacción química en otras más simples. Puede haber dos átomos del mismo elemento con características diferentes y, si tienen diferentes números de masa, pertenecen al mismo elemento pero en lo que se conoce como uno de sus isótopos. También es importante diferenciar entre los «elementos químicos» de una sustancia simple. Los elementos se encuentran en la tabla periódica de los elementos.
Que es un compuesto químico
Contenido
Un compuesto químico es una sustancia formada por la combinación de dos o más elementos diferentes de la tabla periódica. Los compuestos están representados por una fórmula química. Por ejemplo, el agua (H2O) está compuesta por dos átomos de hidrógeno y un átomo de oxígeno.
Los compuestos tienen propiedades intrínsecas y ciertas características tales como: una composición constante y componentes que siempre están en proporciones constantes. Están formados por moléculas o iones con enlaces estables que no se deben a una selección humana arbitraria. Por lo tanto, no son mezclas o aleaciones como el bronce o el chocolate.
Finalmente, los elementos de un compuesto no pueden ser divididos o separados por procesos físicos (decantación, filtración, destilación), sino sólo por procesos químicos.
Como se representan los elementos químicos
Están representados por una mayúscula, o una mayúscula inicial y una minúscula, asociadas al nombre del elemento, aunque a veces no está muy claro porque se trata de nombres derivados del griego o del letón, por ejemplo:
- C carbono
- N Nitrógeno
- F flúor
- Ag plata
- Cobre Cu
- Cesio Cs
- Co cobalto
- Au oro
- Na sodio
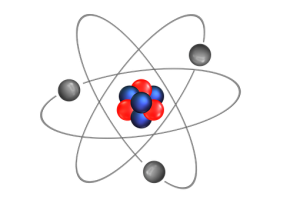
Los elementos químicos se representan como el átomo, el núcleo, donde los protones y los neutrones son neccentrados van adentro, los electrones afuera, girando elípticamente alrededor del núcleo.
El número de electrones y protones depende del elemento. Por ejemplo, el número atómico de oxígeno 8 tiene 8 protones y 8 electrones. El número de neutrones es diferente.
Como se clasifican los elementos químicos
La clasificación más fundamental de los elementos químicos está en los metales y no metales.
- Los metales se caracterizan por su aspecto brillante, su capacidad de cambiar de forma sin romperse (maleable) y su excelente conductividad térmica y eléctrica.
- Los no metales se caracterizan por la falta de estas propiedades físicas, aunque hay algunas excepciones (por ejemplo, el yodo sólido es brillante; el grafito es un excelente conductor de electricidad; y el diamante es un excelente conductor de calor).
- Las características químicas son: los metales tienden a perder electrones para formar iones positivos y los no metales tienden a ganar electrones para formar iones negativos.
- Cuando un metal reacciona con un no metal, normalmente hay una transferencia de uno o más electrones del primero al segundo.
Propiedad de los metales
- Tienen bajo potencial de ionización y alto peso específico
- Como regla general, en su último nivel de energía tienen de 1 a 3 electrones.
- Son sólidos excepto mercurio (Hg), galio (Ga), cesio (Cs) y francio (Fr), que son líquidos.
- Tienen un aspecto y brillo metálico
- Son buenos conductores de calor y electricidad
- Son dúctiles y maleables, algunos son tenaces, otros son blandos.
- Oxidación por pérdida de electrones
- Su molécula está formada por un solo átomo, su estructura cristalina cuando se une al oxígeno forma óxidos y éstos forman hidróxidos cuando reacciona con el agua.
- Los elementos alcalinos son los más activos
Propiedades generales de los no metales
- Tienen una tendencia a ganar electrones
- Tienen alto potencial de ionización y bajo peso específico
- Como regla general, en su último nivel de energía tienen de 4 a 7 electrones
- Se presentan en los tres estados físicos de agregación
- Sin apariencia metálica ni brillo
- Son malos conductores de calor y electricidad.
- No es dúctil, maleable ni tenaz
- Se reducen por la ganancia de electrones
- Sus moléculas están compuestas de dos o más átomos
- Cuando se unen al oxígeno, forman anhídridos, y cuando reaccionan con el agua, forman oxiácidos.
- Los halógenos y el oxígeno son los más activos
- Varios no metales tienen alotropía
La mayoría de los elementos se clasifican como metales. Los metales se encuentran en el lado izquierdo y en el centro de la tabla periódica. Los no metales, que son relativamente pocos en número, están en la parte superior derecha de la tabla. Algunos elementos tienen un comportamiento metálico y no metálico y se clasifican como metaloides y semimetálicos.
Los no metales también tienen propiedades variables, al igual que los metales. En general, los elementos que atraen más eficazmente los electrones de los metales se encuentran en la parte superior derecha de la tabla periódica.
Historia de los elementos químicos
Durante el siglo XVII, un alquimista de origen alemán, Henning Brand, tuvo la idea de que para encontrar una piedra filosofal tenía que obtener oro de la orina humana (quizás por su color). Para el caso, Brand recolectó cinco litros de orina durante varios días y la hirvió, luego la dejó reposar durante dos semanas. Al final, y después de haber eliminado toda el agua, quedó con un residuo sólido. La marca mezcló este residuo con arena, lo calentó fuertemente y recogió sus vapores en un recipiente vacío.
A medida que los vapores se enfriaban en las paredes del contenedor, se formaba un blanco sólido: Y grande fue su asombro al ver la sustancia brillar en la oscuridad. Brand había aislado el fósforo (del griego: portador de luz). Este elemento brilla porque se combina lentamente con el oxígeno del aire, un proceso durante el cual emite energía luminosa. Las propiedades del fósforo no se conocían en ese momento, pero aislar un elemento fue un descubrimiento fantástico.
En el siglo XVIII hubo gran interés entre los químicos por descubrir nuevos elementos gaseosos, y así, entre 1766 y 1774, Henry Cavendish identificó el hidrógeno, Daniel Rutherford el nitrógeno y Carl Scheele el cloro. Otro caso es el de Joseph Priestley que, cuando calentó el monóxido de mercurio, obtuvo dos vapores: uno se había condensado en gotas, era mercurio, pero el otro, ¿qué era? Priestley recogió ese gas desconocido en un recipiente e hizo algunas pruebas: por ejemplo, si ponía una astilla de madera, se quemaría; si traía ratones vivos, se volverían muy activos. Priestley inhaló algo de ese gas y notó que se sentía muy ligero y cómodo. Llamó a este gas aire deflogistizado, hoy sabemos que este gas era oxígeno. Sin saberlo, Priestley fue la primera persona en usar la máscara de oxígeno.
Evidentemente, la lista de elementos aislados e identificados se fue ampliando a lo largo de los años, por lo que surgió la necesidad de ordenarlos. Estos y los descubrimientos posteriores -además de las nuevas tecnologías-, hoy podemos afirmar que, de alguna manera, se han logrado los objetivos de los alquimistas.
Los químicos son capaces de sintetizar sustancias que benefician a toda la humanidad de diferentes maneras. Por ejemplo, se han obtenido artificialmente cientos de isótopos radioactivos que se utilizan en la medicina y la industria.
Está claro que no se ha obtenido el elixir de la vida, el que cura todas las enfermedades, pero se han sintetizado cientos de miles de productos para combatir y prevenir enfermedades y que, por supuesto, mejoran la calidad de vida de las personas.